क्लीनिकल ट्रायल भारत में शुरू: कोरोनावायरस बीमारी के इलाज में संभावित तौर पर मददगार होगी ग्लेनमार्क फार्मास्यूटिकल्स की एंटी वायरल दवा
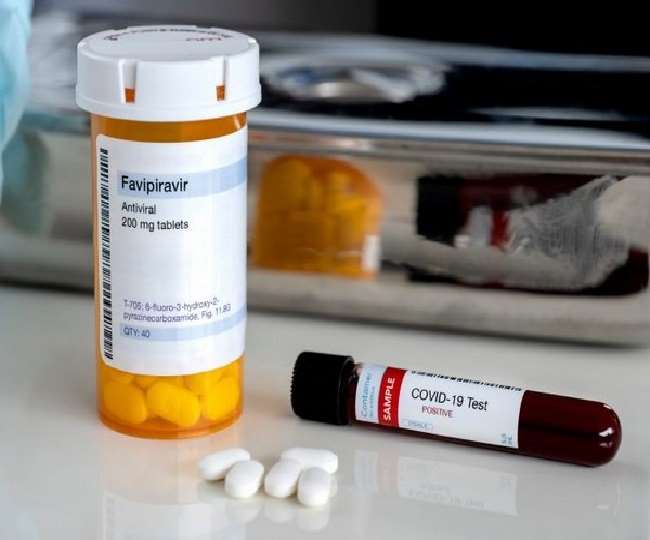
ग्लेनमार्क फार्मास्यूटिकल्स ने एंटी वायरल दवा के तीसरे चरण का क्लीनिकल ट्रायल भारत में शुरू कर दिया है। इसे कोरोनावायरस बीमारी के इलाज में संभावित तौर पर मददगार समझा जा रहा है। देश के दवा नियामक से अप्रैल में इस संबंध में मंजूरी मिलने के बाद ग्लेनमार्क ने यह परीक्षण शुरू किया है। कंपनी की तरफ से जारी किए बयान में बताया क गया कि वह पहली ऐसे कंपनी है, जो भारत में तीसरे फेज का ट्रायल कर करेगी।
मुंबई स्थित ग्लेनमार्क ने कहा कि बीएसई में एक फाइलिंग ने मंजूरी देते हुए इसे भारत की पहली दवा कंपनी बना दिया। कंपनी को भारत के ड्रग कंट्रोलर जनरल द्वारा कोविड-19 रोगियों पर परीक्षण शुरू करने के लिए मंजूरी दी गई है।
एंटी वायरल दवा favipiravir को जापान की फुजीफिल्म होल्डिंग्स कॉर्पोरेशन (Fujifilm Holdings Corporation) की सहायक कंपनी द्वारा निर्मित किए नाम Avigan के तहत बनाया गया है। इसे साल 2014 में एक फ़्लू-विरोधी दवा के रूप में उपयोग करने के लिए अनुमोदित किया गया है।
ग्लेनमार्क का अनुमान है कि उनका अध्ययन जुलाई या अगस्त 2020 तक पूरा हो जाएगा। कंपनी ने अपने इन-हाउस आरएंडडी टीम के माध्यम से उत्पाद के लिए एपीआई और फॉर्मूले विकसित किए हैं।
इसके साथ ही कंपनी की तरफ से कहा गया कि favipiravir इन्फ्लूएंजा वायरस के खिलाफ इस्तेमाल में लाई जा चुकी है। इस वक्त जापान में इस दवा को कोरोना संक्रमण को रोकने के लिए इजाजत मिली हुई है।
नैदानिक विकास, वैश्विक विशेषता / ब्रांडेड पोर्टफोलियो, ग्लेनमार्क फार्मास्युटिकल्स लिमिटेड की उपाध्यक्ष और प्रमुख मोनिका टंडन ने कहा कि स्वास्थ्य और चिकित्सा विशेषज्ञ इस बात को देखने के लिए उत्सुक हैं कि favipiravir को कोरोना वायरस पर क्या प्रभाव पडे़गा। उन्होंने कहा कि हमें विश्वास है कि अध्ययन के परिणाम महत्वपूर्ण होंगे क्योंकि वर्तमान में वायरस के लिए कोई प्रभावी उपचार नहीं है।
साथ ही उन्होंने कहा इन परीक्षणों से हमें जो डेटा मिलता है, वह हमें COVID-19 उपचार और प्रबंधन के संबंध में एक स्पष्ट दिशा में मार्ग प्रदान करेगा।







